Перманганат калия
Содержание:
- Марганец и структура тканей
- Химические свойства
- Кисло-соленый привкус
- Риски
- Внутреннее применение
- Марганцовка
- Нехватка марганца в организме
- Лечение
- Фармакологические свойства
- Химические свойства
- Получение марганцовка
- Марганец в судебно-медицинском отношении
- Методика спринцевания влагалища
- Приготовление раствора
- Достоинства и недостатки
- Что такое марганцовка и ее свойства
- КАЛИЙ МАРГАНЦОВОКИСЛЫЙ
- Марганец и витамины
- Горький привкус во рту
- Физические свойства
- Когда нужно использовать
- Применение
Марганец и структура тканей
Марганец способен улучшать структуру всех тканей организма: и костной, и мышечной, и к тому же он хорошо влияет на работу мозга. Марганец способен влиять на работу всего организма так, что у человека улучшаются функции памяти, повышается внимательность, концентрация на какой-то определенной работе. Марганец влияет на процесс образования кровяных телец и передвижение крови по венам и артериям.
Особенно важен марганец для выведения токсинов из организма и их нейтрализацию. При отравлениях даже в инфекционных отделениях давали раствор слабой марганцовки в больших количествах. Это снижало риск после отравлений, помогало выводить токсины, улучшало работу внутренних органов.
Правда, нужны правильные дозы употребления продуктов с марганцем, чтобы его воздействие на организм было действительно полезным.
Химические свойства
| Окисленная форма | Восстановленная форма | Среда | E, В |
|---|---|---|---|
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |

Слева направо (водные растворы): Co(NO3)2 (красный); K2Cr2O7 (оранжевый); K2CrO4 (жёлтый); NiCl2 (бирюзовый); CuSO4 (голубой); KMnO4 (фиолетовый)
Раствор KMnO4 в воде в мерной колбе
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия):
в кислой среде:
- 2KMnO4+5K2SO3+3H2SO4⟶6K2SO4+2MnSO4+3H2O{\displaystyle {\ce {2KMnO4 + 5K2SO3 + 3H2SO4 -> 6K2SO4 + 2MnSO4 + 3H2O}}};
в нейтральной среде:
- 2KMnO4+3K2SO3+H2O⟶3K2SO4+2MnO2+2KOH{\displaystyle {\ce {2KMnO4 + 3K2SO3 + H2O -> 3K2SO4 + 2MnO2 + 2KOH}}};
в щелочной среде:
- 2KMnO4+K2SO3+2KOH⟶K2SO4+2K2MnO4+H2O{\displaystyle {\ce {2KMnO4 + K2SO3 + 2KOH -> K2SO4 + 2K2MnO4 + H2O}}}.
Однако последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
- 2KMnO4+H2SO4⟶K2SO4+Mn2O7+H2O{\displaystyle {\ce {2KMnO4 + H2SO4 -> K2SO4 + Mn2O7 + H2O}}}.
При этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4{\displaystyle {\ce {MnO3HSO4}}}. По реакции с фторидом иода(V) можно получить аналогичный оксофторид:
- KMnO4+IF5⟶KF+IOF3+MnO3F{\displaystyle {\ce {KMnO4 + IF5 -> KF + IOF3 + MnO3F}}}.
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
- 2KMnO4→∘tK2MnO4 +MnO2 +O2{\displaystyle {\ce {2KMnO4->K2MnO4\ +MnO2\ +O2}}}.
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
- 5KMnO4→∘tK2MnO4 +K3MnO4 +3MnO2 +3O2{\displaystyle {\ce {5KMnO4->K2MnO4\ +K3MnO4\ +3MnO2\ +3O2}}}.
Реагирует с солями двухвалентного марганца, например:
- 2KMnO4+3MnSO4+2H2O⟶5MnO2+K2SO4+2H2SO4{\displaystyle {\ce {2KMnO4 + 3MnSO4 + 2H2O -> 5MnO2 + K2SO4 + 2H2SO4}}}.
Эта реакция в принципе обратна дисмутации (диспропорционирование) K2MnO4{\displaystyle {\ce {K2MnO4}}} на MnO2{\displaystyle {\ce {MnO2}}} и KMnO4{\displaystyle {\ce {KMnO4}}}.
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов (реакция Вагнера):
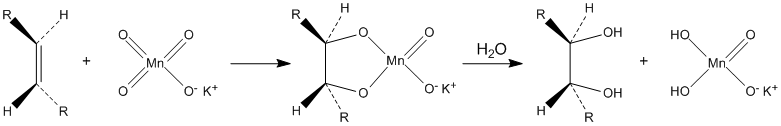
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
- 2KMnO4+3H2O2⟶2MnO2+3O2↑+2H2O+2KOH{\displaystyle {\ce {2KMnO4 +3H2O2 -> 2MnO2 + 3O2 ^ + 2H2O + 2KOH}}}.
Перманганат калия реагирует с концентрированной соляной, бромоводородной или иодоводородной кислотой. В результате выделяются свободные галогены:
- 2KMnO4+16HCl⟶2KCl+2MnCl2+5Cl2↑+8H2O{\displaystyle {\ce {2KMnO4 + 16HCl -> 2KCl + 2MnCl2 + 5Cl2 ^ + 8H2O}}}
Во время химической реакции хлорид-анион Cl−{\displaystyle {\ce {Cl^{-}}}} окисляется до элементарного хлора, а ион Mn7+{\displaystyle {\ce {Mn^{7+}}}} в перманганат-анионе восстанавливается до катиона Mn2+{\displaystyle {\ce {Mn^{2+}}}}:
- 2Cl−⟶Cl2↑{\displaystyle {\ce {2Cl^{-}-> Cl2 ^}}}
- Mn7+⟶Mn2+{\displaystyle {\ce {Mn^{7+}-> Mn^{2+}}}}
Кисло-соленый привкус
Такой симптом может предупреждать о хронической или острой почечной недостаточности – состоянии, при котором почки не работают должным образом, и организм не может выводить токсины из организма. При тяжелой степени почечной недостаточности появляется привкус и меняется запах изо рта. Может ощущаться запах мочи.
Помимо этих симптомов, о развитии хронической почечной недостаточности и необратимом повреждении организма предупреждают слабость, похудание, потеря аппетита, тошнота и рвота. Человек становится сонливым, возникают головные боли и боли в мышцах.
Хроническая почечная недостаточность
Диагностировать почечную недостаточность может уролог. Для этого нужно будет сдать анализы крови и мочи, обследовать почки. В некоторых случаях даже нужно делать биопсию.
Риски
Наиболее значительный риск, связанный с марганцем для людей, это когда они вдыхают его. Плавка и сварка являются двумя видами деятельности с высоким риском случайного вдыхания марганца. Вдыхаемый марганец опасен тем, что организм транспортирует минералы непосредственно в мозг без предварительной обработки. С течением времени этот марганец может привести к серьезному состоянию, называемому манганизм, который похож на болезнь Паркинсона. Симптомы манганизма включают:
- трудности при ходьбе;
- мышечные спазмы на лице;
- тремор;
- раздражительность;
- агрессивность;
- галлюцинации;
- снижение функции легких.
Человек редко может испытывать подобные симптомы.
Научная статья по теме: Марганец может привести к смертельной сердечной инфекции.
Внутреннее применение
Для внутреннего применения перманганата калия раствор показан только при острых отравлениях. Его эффективность в этом случае объясняется тем, что во время контакта жидкости с белками, производимыми человеческим организмом, выделяется активный кислород. Он является грозой микробов. Таким образом, при попадании раствора марганцовки в органы пищеварения происходит процесс перехода опасных химических веществ в неопасную форму.
Дополнительно полезна в случае острого отравления ещё одна особенность марганцовокислого калия – его специфический запах. Благодаря этому можно значительно быстрее и легче вызвать рвоту с целью очищения желудка. После того как раствор будет выпит, не следует спешить с очищением желудка. Лучше какое-то время дать ему проявить своё действие.
Для промывания желудка необходимо приготовить очень слабый раствор марганцовки, где отношение действующего вещества к воде составляет от 0,01:100 до 0,1:100. На практике трудно сохранить точные пропорции, но можно ориентироваться на такие факторы, как количество крупинок и цвет. На литр кипячёной воды обычно берут 3-4 кристалла перманганата калия. Если ориентироваться по окрасу раствора, то после растворения порошка жидкость должна быть бледно-розовой.
Марганцовка
Марганцовка — она же — (перманганат калия) KМnO4: представляет собой темно-фиолетовые кристаллы соли марганцевой кислоты. Марганцовка всегда продаётся в аптеке, как антисептическое противомикробное средство (очень сильный окислитель!). Многие путешественники берут марганцовку с собой для профилактики питьевой воды в дорожных условиях (достаточно растворить несколько кристалликов, как вода значительно очистится).
Концентрированный водный раствор перманганата калия является очень сильным окислителем, он окисляет органические соединения (пластмассу, дерево, красящие вещества).
При нагревании кристаллов марганцовки (200-250С) она постепенно превращается в изумрудно-зелёные тёмные кристаллы марганцовки — это безводная соль — манганат калия K2MnO4. При этом бурно выделяется кислород и образуется двуокись марганца (один из основных способов получения кислорода в лабораторных условиях).
Марганцовка
Марганцовка прекрасно въедается в металлы и может серьёзно испортить Вам, например, металлическую раковину, ванную комнату и т.т. При разливе марганцовки остаются тёмно — коричневые пятна, которые стандартными способами не отмываются. Это происходит по причине распада марганцовки на соединения, одно из которых — оксид марганца MnO2 – тёмно-коричневое рыхлое вещество. Испортили раковину химическим способом, очищать будем также химическим способом.
Нехватка марганца в организме
Лучше, конечно, этого не допускать. Если человек не ест растительной пищи, подвергает ее тепловой обработке, не восполняет дефицит витаминов и микроэлементов с помощью витаминно-минеральных комплексов, то ему грозит нехватка марганца. Она приводит к сбоям в работе нервной системы, нарушению половой функции и у мужчин, и у женщин. Для женщин нехватка марганца может обернуться проблемами с зачатием и вынашивание ребенка.
В состоянии постоянного стресса марганец необходим особенно. Если человек при этом расходует много умственной энергии на работе, марганец просто жизненно необходим. Он помогает восстанавливать клеточные мембраны, выводить токсины из организма, без марганца невозможна нормальная работа нервных клеток.
Лечение

• Отравление
Для применения внутрь при отравлении готовят раствор: в 200 г остуженной кипяченой воды добавляют 2 кристалла марганцовки. Раствор выпивается за один раз. Антисептические свойства марганцовки помогут остановить очаг инфекции в желудке.
• Промывание желудка
Пострадавшему дают выпить от 500 до 1,5 л светло-розового раствора марганцовки, затем надавливают на корень языка для вызова рвотного рефлекса.
• Полоскание горла
В 200 г тёплой кипяченой воды добавить 3 кристалла марганцовки. Полоскания проводить после приема пищи свежеприготовленным раствором. Во время процедуры нельзя заглатывать жидкость. После полоскания смазать миндалины любым растительным маслом и ничего не есть в течение 1 часа.
Марганцовка отрицательно влияет на состояние зубной эмали, поэтому применять полоскания для горла можно не более 2 дней подряд.
• Обработка ран
Для обработки ран используют фильтрованный 0,1% раствор цвета красного густого вина. Но следует учитывать, что обрабатывают только края раны, а не саму поврежденную поверхность.
• Мозоли
Ванночки с раствором марганцовки помогают снять боль при мозолях. В тазик с теплой водой добавляют розовый раствор марганцовки, 1 ст. л. морской соли. Процедуру проводят в течение 15 мин. После ванночки ноги тщательно промокают полотенцем, на мозоль наносят мазь календулы.
Фармакологические свойства
Марганцовка – это фиолетовый порошок, в состав которого входят крошечные кристаллы. При смешивании с водой они образуют красный раствор. В медицине данное средство называют перманганатом калия.
Это средство имеет выраженные антисептические свойства. Они связаны с возможностью вырабатывать активный кислород при контакте с органическими элементами – к примеру, белками дермы человека.
Применение марганцовки при интоксикации базируется на способности окислять большинство соединений, имеющих органическое и неорганическое происхождение. Перманганат калия позволяет получить следующие результаты:

В кале появилась желчь: причины и лечение
- Сделать неактивными химические элементы – к ним, в частности, относятся алкогольные напитки и их суррогаты;
- разрушить стенки клеток множества микробов, которые являются причиной интоксикации организма.
Химические свойства
| Окисленная форма | Восстановленная форма | Среда | E, В |
|---|---|---|---|
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |

Слева направо (водные растворы): Co(NO3)2 (красный); K2Cr2O7 (оранжевый); K2CrO4 (жёлтый); NiCl2 (бирюзовый); CuSO4 (голубой); KMnO4 (фиолетовый)
Раствор KMnO4 в воде в мерной колбе
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия):
в кислой среде:
- 2KMnO4+5K2SO3+3H2SO4⟶6K2SO4+2MnSO4+3H2O{\displaystyle {\ce {2KMnO4 + 5K2SO3 + 3H2SO4 -> 6K2SO4 + 2MnSO4 + 3H2O}}};
в нейтральной среде:
- 2KMnO4+3K2SO3+H2O⟶3K2SO4+2MnO2+2KOH{\displaystyle {\ce {2KMnO4 + 3K2SO3 + H2O -> 3K2SO4 + 2MnO2 + 2KOH}}};
в щелочной среде:
- 2KMnO4+K2SO3+2KOH⟶K2SO4+2K2MnO4+H2O{\displaystyle {\ce {2KMnO4 + K2SO3 + 2KOH -> K2SO4 + 2K2MnO4 + H2O}}}.
Однако последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
- 2KMnO4+H2SO4⟶K2SO4+Mn2O7+H2O{\displaystyle {\ce {2KMnO4 + H2SO4 -> K2SO4 + Mn2O7 + H2O}}}.
При этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4{\displaystyle {\ce {MnO3HSO4}}}. По реакции с фторидом иода(V) можно получить аналогичный оксофторид:
- KMnO4+IF5⟶KF+IOF3+MnO3F{\displaystyle {\ce {KMnO4 + IF5 -> KF + IOF3 + MnO3F}}}.
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
- 2KMnO4→∘tK2MnO4 +MnO2 +O2{\displaystyle {\ce {2KMnO4->K2MnO4\ +MnO2\ +O2}}}.
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
- 5KMnO4→∘tK2MnO4 +K3MnO4 +3MnO2 +3O2{\displaystyle {\ce {5KMnO4->K2MnO4\ +K3MnO4\ +3MnO2\ +3O2}}}.
Реагирует с солями двухвалентного марганца, например:
- 2KMnO4+3MnSO4+2H2O⟶5MnO2+K2SO4+2H2SO4{\displaystyle {\ce {2KMnO4 + 3MnSO4 + 2H2O -> 5MnO2 + K2SO4 + 2H2SO4}}}.
Эта реакция в принципе обратна дисмутации (диспропорционирование) K2MnO4{\displaystyle {\ce {K2MnO4}}} на MnO2{\displaystyle {\ce {MnO2}}} и KMnO4{\displaystyle {\ce {KMnO4}}}.
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов (реакция Вагнера):

Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
- 2KMnO4+3H2O2⟶2MnO2+3O2↑+2H2O+2KOH{\displaystyle {\ce {2KMnO4 +3H2O2 -> 2MnO2 + 3O2 ^ + 2H2O + 2KOH}}}.
Перманганат калия реагирует с концентрированной соляной, бромоводородной или иодоводородной кислотой. В результате выделяются свободные галогены:
- 2KMnO4+16HCl⟶2KCl+2MnCl2+5Cl2↑+8H2O{\displaystyle {\ce {2KMnO4 + 16HCl -> 2KCl + 2MnCl2 + 5Cl2 ^ + 8H2O}}}
Во время химической реакции хлорид-анион Cl−{\displaystyle {\ce {Cl^{-}}}} окисляется до элементарного хлора, а ион Mn7+{\displaystyle {\ce {Mn^{7+}}}} в перманганат-анионе восстанавливается до катиона Mn2+{\displaystyle {\ce {Mn^{2+}}}}:
- 2Cl−⟶Cl2↑{\displaystyle {\ce {2Cl^{-}-> Cl2 ^}}}
- Mn7+⟶Mn2+{\displaystyle {\ce {Mn^{7+}-> Mn^{2+}}}}
Получение марганцовка
Раствор марганцовки
Получение марганцовки в промышленности связано с электролизом концентрированного раствора гидроксида калия с марганцевым анодом. В процессе электролиза материал анода постепенно растворяется с образованием знакомого всем фиолетового раствора, содержащего перманганат-ионы. На катоде происходит выделение водорода. Умеренно растворимый в воде перманганат калия (марганцовка) выделяется в виде осадка.
Было бы заманчиво вместо привычной марганцовки производить перманганат натрия, ведь гидроксид натрия доступнее, чем гидроксид калия. Однако в этих условиях выделить перманганат натрия NaMnO4 невозможно: в отличие от перманганата калия KMnO4, он прекрасно растворим в воде (при 20 °С его растворимость составляет 144 г на 100 г воды).
В нейтральной или слабощелочной среде марганцовка (перманганат) переходит в гидратированный оксид марганца:
2КМnО4+Н2О+3K2SO3→ 2MnO2+3K2SO4+2КОН.
 Перманганата калия. Восстановление в щелочной (2), нейтральной (3), кислой (4) среде
Перманганата калия. Восстановление в щелочной (2), нейтральной (3), кислой (4) среде
В нейтральной или слабощелочной среде перманганат-ион (марганцовка) восстанавливается до оксида марганца (IV):
MnО4+2Н2О+3е → MnО2+4ОН-. Особенно ярко марганцовка проявляет окисляющую способность в кислой среде:
MnО-4+8Н++5е → Mn2++4Н2О.
Подкисленный крепкий раствор перманганата буквально сжигает многие органические соединения, превращая их в углекислый газ и воду. Этим иногда пользуются химики для мытья лабораторной посуды, сильно загрязнённой плохо смываемыми остатками органических веществ.
Твёрдый перманганат калия и его крепкие растворы могут быть опасны. При отравлении концентрированным раствором марганцовки возникает ожог рта, пищевода и желудка. Если вдруг Вы глотнули такой раствор, надо немедленно промыть желудок теплой водой с добавлением активированного угля. Для этого можно также использовать раствор, содержащий в двух литрах воды полстакана слабого раствора (H2O2) и один стакан столового уксуса. В этом случае ионы марганца переходят в менее опасные катионы марганца, а сама химическая реакция протекает следующим образом:
2KMn04+5H2O2+6CH3COOH→ 2Mn(CH3COO)2+5O2+2CH3COOK+8H2O
Марганец в судебно-медицинском отношении
В суд.-мед. практике отравления М. встречаются чрезвычайно редко и носят обычно характер несчастных случаев. Экспертное значение имеют особенности клин, картины: у пострадавших появляется жжение во рту и кровотечение из ротовой полости, затрудненное глотание, сиплость голоса, хриплое дыхание, судороги. Быстро нарастают явления общей слабости, отека легких и мозга. При суд.-мед
исследовании внимание прежде всего привлекает характерная темная окраска кожи и слизистых оболочек. Губы, слизистые оболочки рта, глотки, гортани и пищевода гиперемированы и покрыты характерным «дифтеритическим» налетом
Слизистая оболочка желудка черно-коричневого цвета с кровоизлияниями и полосками некроза, слизистая оболочка кишечника гиперемирована. В подслизистой оболочке лейкоцитарные инфильтраты в виде полос. Иногда развиваются трахеобронхит, очаговая пневмония. В печени мелкокапельная жировая дистрофия, в почках ограниченные некрозы. В селезенке умеренная гиперплазия ретикулоэндотелиальной ткани. В надпочечниках мелкие некротические очаги в ретикулярном слое.
При подостром отравлении М. отмечается резкое полнокровие всех внутренних органов, обширные кровоизлияния в надпочечниках, тромбоз мелких легочных сосудов, паренхиматозная дистрофия и жировая инфильтрация печени и почек, вакуолизация и набухание пирамидальных нейроцитов коры головного мозга, деструкция глиозных околососудистых мембран и периваскулярная лимфоидная инфильтрация.
Выявленные морфологические изменения свидетельствуют о высокой токсичности М.
Суд.-мед. диагностика отравлений М. базируется на клин, картине заболевания, патологоанатомических данных и результатах судебно-химических исследований внутренних органов с учетом и следственных данных.
При суд.-хим. исследовании для обнаружения М. производят минерализацию навесок органов трупа в смеси концентрированных серной и азотной к-т, а затем определяют М. дробным методом по Крыловой (1966).
Чувствительность метода 0,02— 20 М. на 100 г органа.
Библиография Бабенко Г. А. и Решеткина Л. П. Применение микроэлементов в медицине, Киев, 1971, библиогр.; Вредные вещества в промышленности, под ред. It. В. Лазарева и И. Д. Гадаскиной, ч. 3, с. 507 и др., Л., 1977; Крыжановская И. В. Смертельное отравление кристаллами марганцево-кислого калия, Труды Науч. об-ва суд. медиков и криминалистов, в. 5, с. 103, Алма-Ата, 1963; Крылова А. Н. Дробное определение марганца в трупном материале, Труды Ленингр, ин-та усоверш. врачей, в. 49, с. 162, 1966; Лаврухина А. К. и Юкина Л. В. Аналитическая химия марганца, М., 1974, библиогр.; Макарченко А. Ф. Изменения нервной системы при интоксикации марганцем, Киев, 1956, библиогр.; Михайлов В. А. Некоторые актуальные вопросы патогенеза и терапии манганотоксикоза, Гиг. труда и проф. заболев., № 6, с. 14, 1971, библиогр.; Навроцкий В. К. Гигиена труда, с. 198, М., 1974; Нормы радиационной безопасности (НРБ-76), М., 1978; Профессиональные болезни, под ред. А. А. Летавета и др., с. 149, М., 1973; Рапопорт С. М. Медицинская биохимия, пер. с нем., М., 1966, библиогр.; P ы ж к о-ваМ. Н. и Тарасова Л. А. О патогенезе и лечении марганцевого паркинсонизма, Гиг. труда и проф.заболев., № 11, с. 31, 1975, библиогр.; E m а г а А. М. Chronic manganese poisoning in the dry battery industry, Brit. J. industr. Med., v. 28, p. 78, 1971; The Merck index, ed. by P. G. Stecher, N. Y., 1968; Whitlock С. M. a. o. Chronic neurological disease in twomanganese steel workers, Amer, industr. Hyg. Ass. J., v. 27, p. 454, 1966.
Методика спринцевания влагалища
У спринцевания влагалища есть свой алгоритм выполнения процедуры. Заключается он в следующем:
Женщина занимает положение лежа на гинекологическом кресле или кушетке, которые застелены клеенкой и чистой пеленкой или простыней. Снизу под таз подставляется специальное судно, в которое будет стекать раствор. Если делается горячее спринцевание, то судно не нужно, так как при использовании наконечника Морозова или промывателя Пинкуса жидкость по трубке сливается прямо в ведро
После того, как пациентка заняла надлежащую позицию, акушерка осторожно вводит наконечник кружки или другого инструмента во влагалище, снимает зажим с резиновой трубки и жидкость начинает поступать внутрь. Кружку при этом удерживают на высоте около метра над уровнем живота женщины.
С особой осторожностью необходимо проводить спринцевание влагалища девушкам, не имевшим половых контактов, так как имеется шанс повредить девственную плеву. При проведении процедуры таким пациенткам пластиковый наконечник заменяется на резиновый катетер, а раствор вводится под небольшим напором.. Стоит отметить некоторые моменты, при которых спринцевание влагалища не делается
К ним относятся: беременность, менструация, первые несколько дней после родов или аборта. К тому же не надо забывать, что частые промывания могут нарушить естественную микрофлору влагалища, а это уже грозит быстрым размножением патогенных микроорганизмов и, как следствие различного рода осложнениями. Поэтому любое спринцевание, даже если оно лечебное, не должно проводиться без консультации и назначения гинеколога.
Стоит отметить некоторые моменты, при которых спринцевание влагалища не делается. К ним относятся: беременность, менструация, первые несколько дней после родов или аборта. К тому же не надо забывать, что частые промывания могут нарушить естественную микрофлору влагалища, а это уже грозит быстрым размножением патогенных микроорганизмов и, как следствие различного рода осложнениями. Поэтому любое спринцевание, даже если оно лечебное, не должно проводиться без консультации и назначения гинеколога.
Также хотелось бы развеять некоторые мифы по поводу спринцевания влагалища как способа предотвратить наступление беременности или защитить от инфекций, передающихся половым путем. Гинекологами всего мира научно доказано, что ни один раствор не снижает риск нежелательного зачатия, даже если спринцевание было проведено сразу после полового акта. Что касается инфекционных заболеваний — также не имеется никаких достоверных фактов, что промывание влагалища антисептическими растворами помогут избежать заражения.
Приготовление раствора

Что нужно знать, чтобы правильно развести марганцовку для лечебных целей?
Необходимо запомнить, что для 1% раствора марганцовки понадобится 1 г кристаллов марганцовки и 100 г воды. Обыкновенная чайная ложка имеет объем 5 мл. Если насыпать в нее марганцовку и убрать ножом горку, получится 6 г кристаллов. Из этого количества марганцовки для приготовления 1% раствора понадобится 600 мл воды.
1% раствор марганцовки имеет практически черный окрас. Это очень крепкий раствор. Его не применяют для внутреннего потребления во избежание ожогов слизистой. 1% раствор используют для лечения грибковых заболеваний, бородавок, пролежней. Такой раствор оказывает подсушивающее и местно-раздражающее действие, значительно ускоряющие процессы кровообращения.
Для приготовления слабых растворов берут меньшее количество кристаллов марганцовки.
Для приготовления растворов нельзя использовать металлические ёмкости, иначе это химическое вещество вступит в контакт с металлом, что станет причиной потери некоторой части лекарственных свойств и, кроме этого оставит несмываемые следы на посуде. Стеклянные ёмкости лучше всего подходят для приготовления растворов из марганцовки.
Воду для приготовления раствора надо брать теплую кипяченую. В теплой воде растворение кристаллов происходит намного лучше. Проводить полоскания и промывания также гораздо комфортнее тёплым раствором.
Кристаллы марганцовки не следует брать руками, так как можно получить ожог и оставить на коже некрасивые плохо смываемые следы. Взять несколько кристалликов поможет спичка или кончик ножа.
Полученный раствор обязательно профильтруйте через марлю, сложенную в несколько слоев, чтобы нерастворившиеся кристаллики не попали на слизистые или кожу и не стали причиной ожога.
При приготовлении раствора сначала в ёмкость наливают необходимое количество воды, а затем добавляют сухие кристаллы марганцовки.
Раствор перманганата калия сохраняет лечебные свойства в течение нескольких часов после приготовления. Как только жидкость примет коричневую окраску использовать его не имеет смысла: все полезные свойства утеряны.
Крепкий раствор марганцовки при длительном применении может стать причиной ожогов кожи.
Хранить кристаллы марганцовки следует в тёмном, сухом месте в плотно закрытой упаковке или ёмкости.
Достоинства и недостатки
Преимущества сернокислого марганца:
- препарат длительного пролонгированного действия, накапливается в слоях грунта, постепенно высвобождаются питательные вещества;
- полностью растворяется в воде, легко приготовить раствор в домашних условиях;
- используют на любых типах грунта;
- полностью восполняет дефицит марганца и серы в почвенной микрофлоре;
- подкормка обеспечивает полноценное усвоение азота, фосфора и калия в почве и растениях;
- осеннее внесение подготовит сад и кустарники к морозной зиме;
- весеннее внесение оптимизирует процессы роста и развития;
- рекомендуется использование на солонцах, лесных, песчаных почвах.
Недостатки (скорее, особенности):
соединения серы полноценно усваиваются именно в период вегетации.
в закисленном грунте подвижность марганца снижена, перед внесением важно вносить раскислители (известь, мел);
на черноземах и подзолистых грунтах вносят осторожно, при условии острой нехватки элементов серы и марганца;
важно не перекормить растения, передозировка повышает риск интоксикации
Что такое марганцовка и ее свойства
Название марганцовка используется в народе, на самом деле темно-фиолетовые, почти черные, кристаллы называются перманганатом калия. Кристаллики быстро растворяются в воде, особенно в теплой, придавая ей малиновую окраску разных тонов, интенсивность цвета зависит от количества используемых кристаллов. Марганцовка является известным соединением металла, в который входит кислород, калий и сам марганец.
Очень широко применение марганцовокислого раствора в лечении людей и животных. Раствором обрабатывают не только раны (в том числе, инфицированные и гнойные), но и небольшие ссадины, промывают желудок, убирают потницу, опрелости у детей, лечат ожоги, язвы, полощут рот и горло, применяют для спринцевания и т.д. При обработке раневой поверхности происходит дезинфицирование кожного покрова, что приводит к быстрому заживлению ран.
КАЛИЙ МАРГАНЦОВОКИСЛЫЙ
| Хим. формула |
KMnO4 |
|---|---|
| Состояние |
твердое (хрупкие кристаллы) |
| Молярная масса |
158,03 г/моль |
| Плотность |
2,703 г/см³ |
| Т. разл. |
240 °C |
| Растворимость в воде |
6,38 (20 °C) |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Пермангана́т ка́лия (лат. Kalii permanganas, распространённое название в быту — марганцо́вка) — марганцовокислый калий, калиевая соль марганцовой кислоты. Химическая формула — KMnO4. Представляет собой тёмно-фиолетовые, почти чёрные кристаллы, при растворении в воде образующие ярко окрашенный раствор малинового цвета.
Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления составляет 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
Марганец и витамины
Усвоение витаминов благодаря марганцу происходит быстрее, особенно – витаминов группы В, витамина С, витамин Е. С марганцем быстрее размножаются и развиваются новые клетки организма, с ним быстрее заживают ранки, царапины и другие повреждения кожи. С марганцем быстрее и четче работает мозг и обмен веществ происходит быстрее.
Удивительно, но благодаря марганцу людям удается смягчить приступы остеопороза и остеоартроза, ревматоидного артрита. Марганец способствует тому, что хрящи быстрее растут и становятся крепче – эта функция особенно полезна для детей, подростков и людей, которые перенесли травмы костной ткани. Марганец также активно помогает бороться с катарактой, рассеянным склерозом сетчатки и другими заболеваниями глаз, что особенно полезно для людей, которые теряют зрение, а также пожилых людей.
Горький привкус во рту
Горечь – четкий сигнал о проблемах в пищеварительной системе. Горький привкус дает желчь при нарушении работы желчных протоков, желчного пузыря или печени. Когда эти органы функционируют нормально, желчь, протекая по желчевыводящим протокам, беспрепятственно поступает в двенадцатиперстную кишку. При нарушении их работы она может попадать в пищеварительную систему.
Горький привкус во рту
Так бывает при холецистите и камнях в желчном пузыре. В этом случае пациента беспокоит целый ряд симптомов: горький привкус обычно сопровождается болью под ребрами с правой стороны и частой тошнотой, тремором, лихорадкой, потерей аппетита, рвотой.
Длительный прием лекарств
Если вы чувствуете горечь во рту, запишитесь на УЗИ брюшной полости для проверки состояния печени и желчного пузыря. Также нужно сдать биохимический анализ крови, обнаруживающий ферменты печени. В случае тяжелых симптомов выполняют гастроскопию.
До назначения медикаментозного лечения соблюдайте строгую диету, исключив из меню жирные, жареные, маринованные и острые продукты. Скорее всего, гастроэнтеролог назначит прием специальных препаратов – гепатопротекторов, защищающих печень от токсичных веществ и повышающих активность клеток органа.
Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления составляет 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
| Температура, °C | 10 | 20 | 25 | 30 | 40 | 50 | 65 |
|---|---|---|---|---|---|---|---|
| Растворимость, г/100 г воды | 4,22 | 6,36 | 7,63 | 9 | 12,5 | 16,8 | 25 |
Термодинамические свойства
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
|---|---|
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/(моль·K) (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/(моль·K) (т) (при 298 К) |
Когда нужно использовать
Для освобождения желудка от ядовитых соединений рекомендуется использовать воду с небольшим количеством перманганата – вода окрашивается в чуть розоватый цвет. Раны на коже и ожоги лечатся крепким раствором марганцовки. Гнойные образования на ране также обрабатываются сильно концентрированным настоем.
Промывание слизистой желудка требуется, если:
- При отравлении пищей отмечается симптом – тошнота или рвота.
- Требуется избавиться от отравления фальсифицированным алкоголем и дешёвым напитком.
- Развивается интоксикация фосфором либо хинином, синильной кислотой, щелочью.
Человеку с сильной аллергической реакцией на перманганат калия промывать слизистую желудочного тракта нельзя. Возможны побочные эффекты: крапивница и аллергический бронхит или ринит.
Ребёнок и подросток до 18 лет использовать настой должен только по рекомендации лечащего врача. Доза рассчитывается тщательно, чтобы не навредить организму. Грудных детей обычно купают в воде с марганцовкой. Это хорошо обеззараживает и защищает кожу.
Пить раствор для снятия симптомов отравления нельзя. Можно вызвать осложнение в самочувствии пострадавшего. Использование марганца производится чётко по рекомендации врача.
Применение
Лечение марганцовкой проводят при различных кожных заболеваниях: инфицированных ранах, язвах, ожогах.
Марганцовку применяют в комплексном лечении некоторых гинекологических и урологических заболеваний, таких как кольпит и уретрит. Для лечения этих недугов марганцовку используют в качестве раствора для промываний и спринцеваний.
При инфекционно-воспалительных заболеваниях полости рта и горла раствором марганцовки проводят полоскания.
Слабый раствор марганцовки применяют для промывания носа при гайморите, полощут горло при фарингите и ангине.
Но следует понимать, что марганцовка является местным средством. В глубокие ткани при полоскании горла она не проникает, а значит, не может повлиять на возбудителей ангины, которые находятся в глубоких тканях миндалин. Марганцовка убивает бактерии только на поверхности гланд. Поэтому уповать только на полоскании растром марганцовки при ангине не следует
Средство можно применять только в комплексном лечении и с большой осторожностью, чтобы не спровоцировать ожог горла
При сильной потливости ног проводят ванночки с раствором марганцовки.
В слабом растворе марганцовки купают новорожденных.
Способ применения
- Для промываний ран используют водный раствор марганцовки 0,1-0,5%.
- Для проведения полосканий горла и полости рта готовят 0,01% до 0,1% раствор.
- Ожоги и язвенные поверхности смазывают 2% или 5% раствором.
- Для промывания желудка при отравлениях, для спринцеваний и промываний берут раствор 0,1%.


















